
شواهد بالینی مثبت از مطالعات انجام شده روی خواهر و برادرها نشان می دهد که مداخله زودهنگام می تواند با مدیریت خاص بیماری و شروع زودهنگام درمان ERT، در صورت وجود، فرصت های متعددی برای بهبود نتایج برای بیماران ایجاد نماید.1
ERT چه در سنین پایین و چه بعدتر آغاز شود می تواند مؤلفه های بالینی مهم مانند استقامت جسمانی و فاکتورهای ریوی که برای کیفیت زندگی، حفظ قابلیت تحرک و فعالیت های روزمره اهمیت دارند را بهبود بخشد.7,8
شما در حال ترک وب سایت MPSReference هستید. لطفاً برای انتقال به صفحات محتوی اطلاعات مربوط به درمان های جایگزینی آنزیمی موجود خاص لینک زیر را انتخاب کنید.
برای آگاهی از درمان های مورکیو نوع A به Vimizim.com مراجعه کنید
برای آگاهی از درمان های MPS VI به Naglazyme.com مراجعه کنید
برای کسب اطلاعات بیشتر درباره آزمون های بالینی به www.clinicaltrials.gov مراجعه کنید.
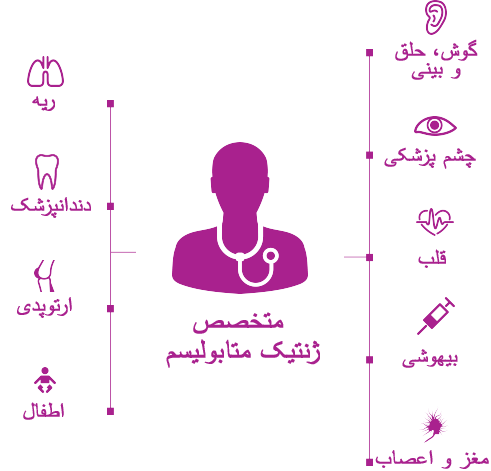
در عصر جدید مدیریت اختلالات پیش رونده و پیچیده ژنتیک مانند موکوپلی ساکاریدوز (MPS) تأکید بر هماهنگی مؤثر تیم مراقبت های بهداشتی بیماران در یک مرکز پزشکی است.1
متخصصان ژنتیک و/یا متخصصان بیماری های متابولیک بطور معمول در مرکز پزشکی نقش محوری داشته و به هماهنگ ساختن مراقبت های چندرشته ای و تهیه یک برنامه مدیریت شخصی کمک می کنند.2,3
با توجه به اینکه تظاهرات گوش و حلق و بینی در MPS بسیار رایج هستند و اغلب در اوایل دوره بیماری نمایان می شوند، متخصص گوش و حلق و بینی نقش مهمی در یک گروه پزشکی چندرشته ای ایفا می کند.4,5

معیارهای مدیریتی و توصیه های خاص تخصص های مختلف برای بسیاری از اختلالات MPS در خصوص مدیریت MPS در کل عمر موجود می باشند. بطور کلی این توصیه ها در معیارها ذکر شده اند:3,7
از آنجائیکه علائم گوش و حلق و بینی اغلب در سنین پایین نمود می یابند، متخصصان گوش و حلق و بینی نقش مهمی برای شروع تشخیص و ارجاع برای آزمایشات ژنتیک جهت تأیید دارند.5 ارزیابی های زودهنگام و مستمر توسط یک گروه مراقبتی هماهنگ می تواند نتایج را برای بیماران بهینه ساخته و جلوی آسیب های غیرقابل بازگشت را بگیرد.7
به دلیل انباشت گلیکوز آمینو گلیکان ها در گوش، بیماران مبتلا به MPS ریسک بالاتری برای ابتلا به عفونت گوش میانی با افیوژن و عفونت حاد گوش میانی دارند.5,8 ملاحظات مدیریت شامل این موارد می باشد:
انسداد مجاری هوای فوقانی در بیماران مبتلا به MPS می تواند بصورت درجات مختلف آپنه خواب تا شرایط اضطراری مجاری هوا که مهلک هستند متغیر باشد. راهکارهای مدیریت برای انسداد مجاری هوا عبارتند از5:
بسیار مهم است که بدانیم اگرچه تظاهرات و عوارض گوش و حلق و بینی تقریباً در تمام انواع MPS وجود دارد، اما علائم و نشانه ها می توانند در میان اختلالات مختلف MPS متفاوت باشند.5 بر اساس علائم مشاهده شده و نوع MPS باید برنامه های مدیریت فردی بر اساس نیازهای خاص شخص تهیه گردد.
یک خلاصه از خصوصیات کلی و خصوصیات گوش و حلق و بینی سندروم های MPS را می توانید در زیر بیابید.
برگرفته از Yueng, Arch Otolaryngol Head Neck Surg, 2009.
دفعات ارزیابی و میزان مشارکت متخصصان مختلف به نوع زیرگروه MPS بستگی دارد. در مورد بیمارانی با بیماری های MPS که عمدتاً دارای عوارض زوال دهنده عصبی و شناختی باشند مانند MPS I، II، III انجام ارزیابی های منظم عصبی رفتاری و روان شناسی توصیه شده است.7,12,13
علاوه بر ارزیابی های تخصص های مختلف که برای تسهیل نتایج مثبت بلندمدت برای بیماران MPS انجام می شوند، پزشک هماهنگ کننده که معمولاً یک متخصص ژنتیک یا متخصص بیماری های متابولیک است نیز می تواند اقدامات مهمی درباره وضعیت سلامت کلی انجام دهد. نقش آنها در اطلاع رسانی به سایر متخصصان بهداشتی و درمانی (مانند دندانپزشکان، متخصصان فیزیوتراپی، متخصصان اطفال، پزشکان خانواده) و خانواده ها درباره بیماری و راهبردهای کلی مدیریت بیسار مهم بوده و باید شامل این موارد باشد:
ارزیابی های تخصصی و نیز معاینات جسمانی منظم و مداخله های مربوط به وضعیت کلی سلامتی باید بر اساس معیارهای توصیه شده انجام شوند که به زیرگروه MPS بستگی خواهد داشت.3
بهبود کیفیت درمان ها برای اختلالات MPS به بهتر شدن نتایج بلندمدت برای بیماران منجر شده و ناگزیر باید رویکردهای جدید در زمینه مدیریت در کل عمر اتخاذ گردد.
با بالا رفتن سن بیماران برخی از آنها شاید بتوانند مراقبت های بهداشتی و درمانی خود را مدیریت کرده ولذا اهمیت گذار به دوره بزرگسالی با هدایت پزشک دو چندان می شود.3 پزشکان باید از موارد زیر اطمینان حاصل کنند:
گذار از مراقبت های اطفال به مراقبت های بزرگسالان و مراقبت های بلندمدت بزرگسالان جزو زمینه های مهمی هستند که باید در برنامه های مراقبتی نوجوانان و بزرگسالان بیمار به آنها توجه شود.3 ملاحظات مراقبت های بلندمدت بطور ایده آل در مراکزی که دارای تجربه گسترده در زمینه MPS باشند رعایت خواهد شد و نیاز به هماهنگی دقیق میان تخصص های مختلف دارد.3,15 مسائل بلندمدت شامل ولی نه محدود به این موارد هستند:
مدیریت بلندمدت اختلالات MPS – شامل ارزیابی های مستمر و راهبر گذار در مراکز برای رفتن از مراقبت های اطفال به مراقبت های بزرگسالان – می تواند بهبود ماندگاری در کیفیت زندگی بیماران شما ایجاد کرده و آینده بهتری را برای آنها رقم بزند.3,15–17
از آنجائیکه تظاهرات بالینی اختلالات موکوپلی ساکاریدوز (MPS) مولتی سیستمیک هستند، برای تشخیص و مدیریت عوارض نیاز به یک رویکرد چندرشته ای و اختصاصی برای هر بیمار است. تظاهرات و عوارض گوش، حلق و بینی در میان تمام انواع MPS تقریباً فراگیر است.1
بیماران مبتلا به MPS بطور معمول نیاز زیادی به جراحی در طول عمر خواهند داشت. در یک مطالعه تاریخچه طبیعی که گروهی متشکل از 325 بیمار مبتلا به مورکیو نوعA (MPS IVA) را مورد ارزیابی قرار داده بود مشخص گردید که بیش از 70% بیماران حداقل یک عمل جراحی انجام داده اند.2

بیماران مبتلا به MPS دارای نرخ مرگ و میر بالائی در طول عمل هستند که دلایل مختلفی اعم از انسداد مجاری هوای فوقانی و تحتانی، ناپایداری نخاع گردنی، نارسائی تنفسی، بیماری های قلبی عروقی و عفونت های مکرر دارد.2-4 بعنوان مثال، عوارض جراحی منجر به فوت 11% بیماران مبتلا به مورکیو نوع A (n=27) گردید.5
تهیه یک برنامه جراحی اهمیت زیادی دارد و برای آن نیاز به یک گروه متخصص در رشته های مختلف است که بطور ایده آل در زمینه درمان بیماران مبتلا به MPS هم تجربه داشته باشند.3
ایجاد آمادگی برای ریسک جراحی و بیهوشی در بیماران مبتلا به MPS نیاز به یک گروه باتجربه و چندرشته ای متشکل از تخصص های بیهوشی، قلب، ریه و گوش و حلق و بینی دارد.3
عوامل خطرزای بیهوشی شامل موارد زیر هستند که در شکل نشان داده شده اند.
ارزیابی ریسک جراحی و پایش در طول عمل جزو مؤلفه های بنیادی یک برنامه جراحی اختصاصی هستند و می توانند ریسک تبعات منفی جراحی و مرگ و میر در بیماران مبتلا به MPS را کاهش دهند.3,9,10
پلی سومنوگرافی ابزار بسیار مفیدی برای ارزیابی وضعیت بیماران مبتلا به MPS پیش از عمل جراحی است1
References: 1. McGill JJ, Inwood AC, Coman DJ, et al. Enzyme replacement therapy for mucopolysaccharidosis VI from 8 weeks of age—a sibling control study. Clin Genet. 2010;77(5):492-498. doi:10.1111/j.1399-0004.2009.01324.x. 2. Furujo M, Kubo T, Kosuga M, Okuyama T. Enzyme replacement therapy attenuates disease progression in two Japanese siblings with mucopolysaccharidosis type VI. Mol Genet Metab. 2011;104(4):597-602. doi:10.1016/j.ymgme.2011.08.029. 3. Clarke LA. Pathogenesis of skeletal and connective tissue involvement in the mucopolysaccharidoses: glycosaminoglycan storage is merely the instigator. Rheumatology (Oxford). 2011;50(suppl 5):v13-18. 4. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48. 5. Morishita K, Petty RE. Musculoskeletal manifestations of mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v19-v25. doi:10.1093/rheumatology/ker397. 6. Muenzer J, Beck M, Eng CM, et al. Long-term, open-labeled extension study of idursulfase in the treatment of Hunter syndrome. Genet Med. 2011;13(2):95-101. doi:10.1097/GIM.0b013e3181fea459. 7. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 8. Muenzer J. Early initiation of enzyme replacement therapy for the mucopolysaccharidoses. Mol Genet Metab. 2014;111(2):63-72. doi:10.1016/j.ymgme.2013.11.015. 9. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 10. Bagewadi S, Roberts J, Mercer J, Jones S, Stephenson J, Wraith JE. Home treatment with Elaprase® and Naglazyme® is safe in patients with mucopolysaccharidoses types II and VI, respectively. J Inherit Metab Dis. 2008;31(6):733-737. doi:10.1007/s10545-008-0980-0. 11. BioMarin Pharmaceutical Inc. VIMIZIM website. http://www.vimizim.com/. Accessed December 21, 2015. 12. BioMarin Pharmaceutical Inc. NAGLAZYME website. http://www.naglazyme.com/. Accessed December 21, 2015. 13. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416.
References: 1. Agency for Healthcare Research and Quality. Defining the PCMH. https://pcmh.ahrq.gov/page/defining-pcmh. Accessed December 15, 2015. 2. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 3. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 4. Mesolella M, Cimmino M, Cantone E, et al. Management of otolaryngological manifestations in mucopolysaccharidoses: our experience. Acta Otorhinolaryngol Ital. 2013;33(4):267-272. 5. Wold SM, Derkay CS, Darrow DH, Proud V. Role of the pediatric otolaryngologist in diagnosis and management of children with mucopolysaccharidoses. Int J Pediatr Otorhinolaryngol. 2010;74(1):27-31. doi:10.1016/j.ijporl.2009.09.042. 6. Spinello CM, Novello LM, Pitino S, et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1-10. doi:10.1155/2013/791983. 7. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416. 8. Simmons MA, Bruce IA, Penney S, Wraith E, Rothera MP. Otorhinolaryngological manifestations of the mucopolysaccharidoses. Int J Pediatr Otorhinolaryngol. 2005;69(5):589-595. doi:10.1016/j.ijporl.2005.01.017. 9. Motamed M, Thorne S, Narula A. Treatment of otitis media with effusion in children with mucopolysaccharidoses. Int J Pediatr Otorhinolaryngol. 2000;53(2):121-124. 10. Yeung AH, Cowan MJ, Horn B, Rosbe KW. Airway management in children with mucopolysaccharidoses. Arch Otolaryngol Head Neck Surg. 2009;135(1):73-79. doi:10.1001/archoto.2008.515. 11. Hendriksz CJ, Harmatz P, Beck M, et al. Review of clinical presentation and diagnosis of mucopolysaccharidosis IVA. Mol Genet Metab. 2013;110:54-64. doi:10.1016/j.ymgme.2013.04.002. 12. Neufeld EF, Muenzer J. The mucopolysaccharidoses. In: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The Metabolic and Molecular Bases of Inherited Disease. Vol 3. 8th ed. New York: McGraw-Hill; 2002:2465-2494. 13. Scarpa M, Almassy Z, Beck M, et al. Mucopolysaccharidosis type II: European recommendations for the diagnosis and multidisciplinary management of a rare disease. Orphanet J Rare Dis. 2011;6:72. doi:10.1186/1750-1172-6-72. 14. James A, Hendriksz CJ, Addison O. The oral health needs of children, adolescents and young adults affected by a mucopolysaccharide disorder. JIMD Rep. 2012;2:51-58. doi:10.1007/8904_2011_46. 15. Coutinho MF, Lacerda L, Alves S. Glycosaminoglycan storage disorders: a review. Biochem Res Int. 2012;2012:471325. doi:10.1155/2012/471325. 16. Kakkis ED, Neufeld EF. The mucopolysaccharidoses. In: Berg BO, ed. Principles of Child Neurology. New York, NY: McGraw-Hill; 1996:1141-1166. 17. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48.
References: 1. Wold SM, Derkay CS, Darrow DH, Proud V. Role of the pediatric otolaryngologist in diagnosis and management of children with mucopolysaccharidoses. Int J Pediatr Otorhinolaryngol. 2010;74(1):27-31. doi:10.1016/j.ijporl.2009.09.042. 2. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 3. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 4. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 5. Lavery C, Hendriksz C. Mortality in patients with Morquio syndrome A. J Inherit Metab Dis Rep. 2015;15:59-66. doi:10.1007/8904_2014_298. 6. Theroux MC, Nerker T, Ditro C, Mackenzie WG. Anesthetic care and perioperative complications of children with Morquio syndrome. Paediatr Anaesth. 2012;22(9):901-907. doi:10.1111/j.1460-9592.2012.03904.x. 7. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 8. Scarpa M, Almassy Z, Beck M, et al. Mucopolysaccharidosis type II: European recommendations for the diagnosis and multidisciplinary management of a rare disease. Orphanet J Rare Dis. 2011;6:72. doi:10.1186/1750-1172-6-72. 9. Solanki GA, Martin KW, Theroux MC, et al. Spinal involvement in mucopolysaccharidosis IVA (Morquio-Brailsford or Morquio A syndrome): presentation, diagnosis and management. J Inherit Metab Dis. 2013;36(2):339-355. doi:10.1007/s10545-013-9586-2. 10. Vitale MG, Skaggs DL, Pace GI, et al. Delphi Consensus Report: Best practices in intraoperative neuromonitoring in spine deformity surgery: development of an intraoperative checklist to optimize response. Spine Deformity. 2014;2(5):333-339. doi:10.1016/j.jspd.2014.05.003. 11. Solanki GA, Alden TD, Burton BK, et al. A multinational, multidisciplinary consensus for the diagnosis and management of spinal cord compression among patients with mucopolysaccharidosis VI. Mol Genet Metab. 2012;107:15-24. doi:10.1016/j.ymgme.2012.07.018. 12. Spinello CM, Novello LM, Pitino S, et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1-10. doi:10.1155/2013/791983.