
دهه های متمادی پژوهش و تجربه بالینی ما را به عصر جدیدی از مدیریت بهینه اختلالات موکوپلی ساکاریدوز (MPS) رسانده است. این استاندارد مراقبتی MPS که با سرعت در حال پیشرفت است، متکی به یک متخصص ژنتیک در مرکزیت مدل ارائه مراقبت های درمانی است که می تواند مراقبت های هماهنگ چندرشته ای را فراهم کرده و فرصت بی نظیری برای تغییر زندگی بیماران به پزشکان می دهد.1–3
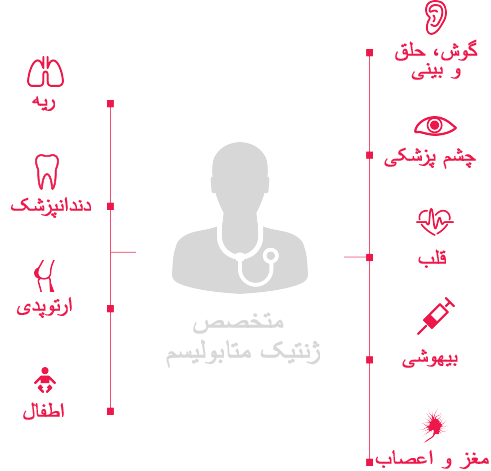
ماهیت ناهمگن و متغیر اختلالات MPS نیاز به رویکردهای شخصی در مراقبت های هماهنگ بیماران را مطرح می سازد.4 هدف مراقبت های هماهنگ کمک به بیماران در دست یافتن به کیفیت زندگی بهتر است که شامل این موارد می باشد:
در مورد کودکان مبتلا به بیماری های حاد، پیچیده و مولتی سیستمیک ژنتیک مانند MPS، مراقبت به شیوه هماهنگ به منظور کاستن از نیاز به استفاده از مراقبت های درمانی و بهبود نتایج سلامتی.5–8
هماهنگی درون خانه پزشکی باید در تمام مؤلفههای سیستم جامع درمانی (مانند مراقبتهای تخصصی، بیمارستانها، مراقبتهای بهداشتی خانگی و خدمات اجتماعی) و در برنامههای شخصی مدیریت بیماران اجرا گردد.3
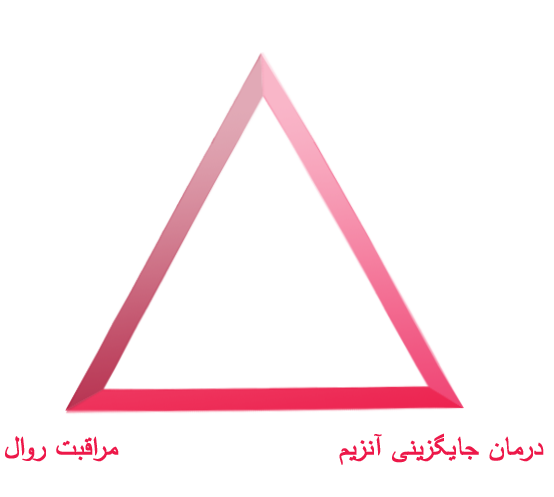
اعمال مدیریت بهینه بیماری MPS با در نظر گرفتن سه اصل مراقبت زیر می تواند به بهبود نتایج برای بیماران کمک کند:
به موازات خانه پزشکی، متخصصان ریه نقش مهمی در شکل دادن به برنامههای مدیریت شخصی دارند. این برنامهها به ERT، مراقبت دائمی، و مراقبتهای رویهای میپردازند، و نهایتاً در بهبود نتایج برای بیماران مفید واقع میشوند.2, 3, 13
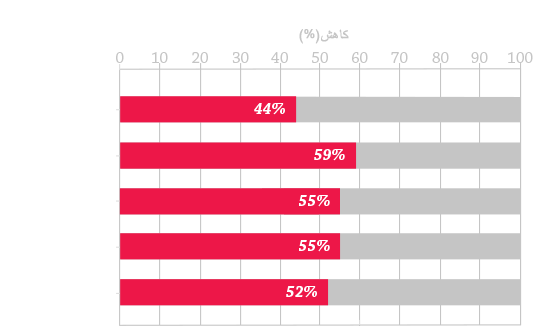
بهترین شیوه های اجرائی در مدیریت در کل عمر می توانند به بهبود نتایج بالینی و کیفیت زندگی بیماران کمک کنند.15-18
اگرچه هریک از زیرگروه های اختلالات MPS از لحاظ بالینی متفاوت هستند اما تمام آنها دارای خصوصیات کوتاه کننده عمر، پیشروندگی و تظاهرات مولتی سیستمیک مشترک در پاتولوژی بیماری MPS می باشند.14,16,23,24 مدیریت بیماران مبتلا به MPS نیاز به درک تظاهرات خاص بالینی و توصیه های مدیریتی برای هریک از زیرگروه های MPS دارد.2,13
نوامبر 2015
علیرغم تنظیمات متعدد امکان بیهوشی بهینه دوطرفه زایمان نبود و برای عمل سزارین نیاز به بیهوشی سیستمیک بود.
می 2015
تشخیص به دلیل عدم وجود یا فاصله زیاد با مراکز و امکانات تشخیصی با تأخیر روبرو شد و منجر به تشخیص های دیگر و علائم گمراه کننده گردید. تعدادی از بیماران تظاهرات و علامت هائی را تجربه کردند که از آنچه که انتظار می رفت کم رنگ تر بودند ولذا مد نظر قرار داده نشدند. این موارد همچنین چالش های منحصر بفردی را نشان می دهند که در تشخیص MPS VI توسط تخصص های مختلف وجود دارد و مطالبی درباره تظاهرات اولیه این بیماران ارائه می کنند.
آوریل 2016
اطلاعات ما درباره سایر مسائل قلبی در میان بزرگسالان مبتلا به MPS، بخصوص در زمینه گردش خون در عروق کرونر و ميوکاردیوم ناچیز است و برای اینکه بتوانیم مراقبت های موثری از این جمعیت نوظهور بزرگسالان بعمل آوریم نیاز به دانش و اطلاعات بیشتر است.
References: 1. Hendriksz CJ et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1–15. 2. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27–S34. 3. Agency for Healthcare Research and Quality. Defining the PCMH. https://pcmh.ahrq.gov/page/defining-pcmh. Accessed December 15, 2015. 4. Hendriksz CJ et al. Review of clinical presentation and diagnosis of mucopolysaccharidosis IVA. Mol Genet Metab. 2013;110:54–64. 5. Casey PH et al. et al. Effect of hospital-based comprehensive care clinic on health costs for Medicaid-insured medically complex children. Arch Pediatr Adolesc Med. 2011;165(5):392–398. 6. Mosquera RA et al. Effect of an enhanced medical home on serious illness and cost of care among high-risk children with chronic illness: a randomized clinical trial. JAMA. 2014;312(24):2640–2648. 7. Klitzner TS et al. Benefits of care coordination for children with complex disease: a pilot medical home project in a resident teaching clinic. J Pediatr. 2010;156(6):1006–1010. 8. Gordon JB et al. A tertiary care-primary care partnership model for medically complex and fragile children and youth with special health care needs. Arch Pediatr Adolesc Med. 2007;161(10):937–944. 9. Chiang J et al. Tachypnea of infancy as the first sign of Sanfilippo syndrome. Pediatrics. 2014;134(3):e884–e888. 10. Muhlebach MS et al. Respiratory manifestations in mucopolysaccharidoses. Paediatr Respir Rev. 2011;12(2):133–138. 11. Berger KI et al. Respiratory and sleep disorders in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):201–210. 12. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91–95. 13. Muenzer J et al. International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19–29. 14. Muenzer J et al. Long-term, open-labeled extension study of idursulfase in the treatment of Hunter syndrome. Genet Med. 2011;13(2):95-101. . 15. Kakkis ED et al. The mucopolysaccharidoses. In: Berg BO, ed. Principles of child neurology. New York, NY: McGraw-Hill; 1996:1141–1166. 16. Lehman TJA et al. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41–v48. 17. Lavery Cet al. Mortality in patients with Morquio syndrome A. J Inherit Metab Dis Rep. 2015;15:59–66. 18. Giugliani R et al. Natural history and galsulfase treatment in mucopolysaccharidosis VI (MPS VI, Maroteaux-Lamy syndrome) –10-year follow-up of patients who previously participated in an MPS VI Survey Study. Am J Med Genet A. 2014;164A(8):1953–1964. 19. Spinello CM et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1–10. d 20. Data on file. Biomarin Pharmaceutical, Inc. 21. Drummond JC et al. Paraplegia after epidural-general anesthesia in a Morquio patient with moderate thoracic spinal stenosis. Can J Anesth. 2015;62(1):45–49. 22. Sharkia R et al. Sanfilippo type A: new clinical manifestations and neuro-imaging findings in patients from the same family in Israel: a case report. J Med Case Rep. 2014;8:78. 23. Clarke LA et al. Biomarkers for the mucopolysaccharidoses: discovery and clinical utility. Mol Genet Metab. 2012;106(4):396–402. 24. Morishita K et al. Musculoskeletal manifestations of mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v19–v25.